Khái niệm về sự cân bằng hóa học.
Khi khảo sát các phản ứng hóa học người ta nhận thấy có rất ít phản ứng hóa học di chuyển chỉ theo một chiều. Đa số các phản ứng hóa học đều di chuyển thuận nghịch. Khi bắt đầu có sự tạo thành sản phẩm là có phản ứng theo chiều ngược lại hay có thể nói ngay từ lúc có những phân tử sản phẩm xuất hiện là bắt đầu có phản ứng nghịch.
Khi tốc độ của phản ứng di chuyển theo chiều thuận và theo chiều nghịch bằng nhau và nồng độ của chất tham gia phản ứng và của nồng độ sản phẩm không thay đổi theo thời gian nữa là cân bằng hóa học đã đạt đến.
Cân bằng hóa học là một quá trình cân bằng động. Hãy tưởng tượng như những người đang trượt tuyết trên 1 dốc thoải. Lượng người đang đi lên và trượt xuống liên tục nối tiếp nhau thay đổi nhưng tổng số người tham dự trượt tuyết từ đỉnh tới chân dốc không thay đổi.
Khi nói đến cân bằng hóa học là nói đến có ít nhất 2 chất khác nhau: chất tham gia phản ứng và sản phẩm.
Khi nói đến cân bằng vật lý là chỉ đề cập đến một chất có trong 2 pha (thể) khác nhau và sự thay đổi sản phẩm chỉ là thay đổi về lý tính. Thí dụ trong sự bay hơi nước số mol H2O thóat ra khỏi thể lỏng bằng với số mol H2O chuyển thành thể khí:
H2O (l) ⇔ H2O (k)
Một thí dụ điển hình của cân bằng hóa học là phản ứng:
N2O4 (k) ⇔ 2NO2 (k) (1)
Đây là phản ứng tạo thành khí nitơ dioxyd (NO2) từ khí dinitơ tetraoxyd (N2O4). Có thể theo dõi diễn biến của phản ứng này dễ dàng do N2O4 là khí không có màu trong khi NO2 có màu nâu đậm. Nếu bơm một lượng chính xác N2O4 vào một bình cầu trong đó là chân không thì màu nâu của sẽ xuất hiện ngay chứng tỏ là NO2 có mặt. Màu nâu sẽ đậm dần do N2O4 tự phân ly. Đến khi đạt cân bằng thì màu không đổi nữa.
Đối với phản ứng ngược với phản ứng (1)
2NO2(k) ⇔ N2O4 (k) (2)
Trong các hình minh họa 1 và 2 vòng màu nâu đen đại diện cho khí NO2 và vòng trắng đại diện cho khí N2O4.
Nếu bắt đầu với NO2, có thể minh họa cân bằng đạt đến như sau:

Chuyển 2NO2 (k) ⇔ N2O4 (k), hệ thống cân bằng ở các ô 4, 5 và 6
Nếu bắt đầu với N2O4, ở cùng nhiệt độ có thể minh họa cân bằng đạt đến là

. Chuyển N2O4 (k) ⇔ 2NO2 (k), hệ thống cân bằng ở các ô 10, 11 và 12
Tuỳ theo nhiệt độ và khối lượng ban đầu của N2O4 (có thể có lẫn NO2 hay không) đã sử dụng mà nồng độ của NO2 và N2O4 ở trạng thái cân bằng của hệ này sẽ khác hệ khác.
Chú ý:
- Một hệ thống cân bằng không cần bất cứ năng lượng nào để duy trì sự cân bằng.
- Không nên lẫn lộn trạng thái cân bằng và trạng thái tĩnh. Trạng thái tĩnh là trạng thái mà các nồng độ đều không đổi theo thời
- Cân bằng hóa học là trạng thái động trong đó chất tham gia phản ứng và sản phẩm chuyển đổi liên tục cho nhau. Tốc độ mất đi và xuất hiện của chúng bằng nhau.
Bảng 1 nêu vài dữ liệu thực nghiệm liên quan đến phản ứng này ở 25 độ C. Nồng độ của khí được diễn tả bằng nồng độ mol và được tính từ số phân tử của khí có mặt từ lúc phản ứng bắt đầu cho đến lúc phản ứng cân bằng xảy ra trong 1 thể tích của bình cầu (tính bằng lít).
Phân tích các dữ liệu từ sự cân bằng sẽ cho thấy trong khi tỷ số [NO2]/[N2O4] cho những giá trị thay đổi thì tỷ số ([NO2]2 / [N2O4]) lại gần như hằng định và trung bình là 4,63 x 10-3.
Giá trị trung bình này gọi là hằng số cân bằng K đối với phản ứng này ở 25 độ C. Biểu thức toán học của hằng số cân bằng đối với hệ NO2 – N2O4 là
![]()
Cũng cần chú ý là số mũ 2 của [NO2] trong biểu thức trên bằng hệ số cân bằng tỷ lượng của NO2 trong phương trình (1).
Khái niệm này thu được khi xét phương trình của phản ứng thuận nghịch:
A + B ⇔ C + D (3)
- A, B: Các chất tham gia phản ứng
- C, D: Sản phẩm tạo thành.
Phương trình (3) là biểu thức toán học tuân theo định luật tác dụng khối lượng.
Bảng 1. Giá trị các tỷ số nồng độ của NO2 và N2O4
| Nồng độ ban đầu (M) | Nồng độ cân bằng (M) | Giá trị các tỷ số nồng độ | |||
| [NO2] | [N2O4] | [NO2] | [N2O4] | [NO2]/[N2O4] | [NO2]2 / [N2O4] |
| 0,000 | 0,670 | 0,0547 | 0,643 | 0,0851 | 4,65 x 10-3 |
| 0,0500 | 0,446 | 0,0457 | 0,448 | 0,102 | 4,66 x 10–3 |
| 0,0300 | 0,500 | 0,0475 | 0,491 | 0,0967 | 4,60 x 10-3 |
| 0,0400 | 0,600 | 0,0523 | 0,594 | 0,0880 | 4,60 x 10-3 |
| 0,200 | 0,000 | 0,0204 | 0,0898 | 0,227 | 4,63 x 10–3 |
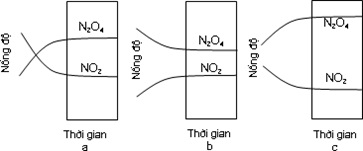
Biến đổi nồng độ của NO2 và N2O4 theo thời gian a) Lúc đầu chỉ có NO2; b) Lúc đầu chỉ có N2O4; c) Lúc đầu có hỗn hợp NO2 và N2O4

